Elektrochemie se zabývá rovnováhami a ději v soustavách, které obsahují elektricky nabité částice.
Nabitá elektrická dvojvrstva vznikne například ponořením kovu do roztoku soli téhož kovu, tomu se pak říká poločlánek:
- měď v roztoku CuSO4 (tzv. katoda) - měď bude přecházet z roztoku do kovu a kov se bude kladně nabíjet
- zinek v roztoku ZnSO4 (zinek je anoda) - zinek bude přecházet z kovu do roztoku a kov se tak bude nabíjet záporně
Spojením dvou takových různě nabitých poločlánků získáme článek. Když spojíme ty dva zmiňované články (měďový a zinkový), říká se tomu
Danielův článek. Další články najdete níže...
Roztoky jsou v Danielově článku spojené solným můstkem, což je roztok vodivé soli na konci s vatičkou (takže se můstkem mohou přesouvat elektrony,
ale ne ionty). Kovy pak spojíme voltmetrem a zjistíme, že je mezi nimi napětí (zinek je nabitý záporně, měď kladně).
i Danielův článek je popsán na obrázku vpravo (na mobilních zařízeních dole pod textem).
Redukční potenciál
Abychom měli relativní univerzální poločlánek, vůči kterému bychom mohli vyjadřovat napětí, zavedl se standardní redukční potenciál.
Ten se značí E0 a rovná se napětí mezi poločlánkem a univerzálním poločlánkem zvaným "vodíková elektroda" za 25°C a standardního tlaku.
Vodíková elektroda je právě ta, od které se potenciály odvozují, sama má potenciál nula. Vodíková elektroda je platinová čerň v roztoku HCl.
i Vodíková elektroda je popsána na obrázku vpravo (na mobilních zařízeních dole pod textem).
Seřazením redukčních potenciálů vznikla Beketovova řada napětí kovů:
- Li, K, Ca, Na, Mg, Al, Zn, Cr, Fe, Ni, Sn, Pb --- H --- Bi, Cu, Ag, Hg, Pt, Au (viz kapitola Kovy)
- kovy vlevo jsou redukční činidla pro kovy lěžící od něj vpravo
- kovy vlevo dokáží vytěsnit ty vpravo
- kovy vlevo jsou raději kationty, kovy vpravo jsou nejraději ryzí
- neušlechtilé kovy jsou vlevo od vodíku, ušlechtilé kovy jsou vpravo od vodíku
Galvanické články
Galvanické články jsou například tužkové a ploché baterky. Mohou se ale vyskytovat i na místech, kde je nechceme.
DANIELŮV ČLÁNEK
- nejjednodušší
- napětí 1,1 V
SUCHÝ ČLÁNEK
- "tužková baterie"
- vynalezen 1866 G. Leclancheem
- napětí 1,5 V
- napětí v suchém článku docela dlouho vydrží
- oxidace na anodě: Zn → Zn2+ + 2e-
- Zn2+ + NH4Cl + 2 OH- → [Zn(NH3)2Cl2] + 2 H2O
- záporný náboj (elektrony vzniklé oxidací) se na anodě shromažďuje, protože nemá kam jít
- až když uzavřeme elektrický obvod (zapojíme baterku do obvodu), mohou elektrony přejít na katodu a tam redukovat mangan z ox.č. IV na ox.č. III:
2 MnIVO2 + 2 H2O + 2 e- → 2 MnIIIO(OH) + 2OH-
Souhrnná reakce na suchém článku tedy vypadá takto: Zn + 2 NH4Cl + MnO2 → [Zn(NH3)2Cl2] + 2 MnO(OH)
Zkrat je zapojení článku bez spotřebiče, elektrony se přesunou a baterka se okamžitě vybije - zničí.
i Suchý článek je popsán na obrázku vpravo (na mobilních zařízeních dole pod textem).
RTUŤOVÝ ČLÁNEK
- např. malé knoflíkové baterky v hodinkách
- napětí 1,35 V
- vydrží déle než suchý článek
- reakce: Zn + HgO → Hg + ZnO
- obal z nerezové oceli
- anoda: lisovaný amalgamový zinkový prášek
- katoda: směs HgO a grafitu
Akumulátory
Akumulátory můžeme narozdíl od galvanických článků opakovaně vybíjet a nabíjet:
- vybíjení: funguje stejně jako u galvanických článků chemickou reakcí
- nabíjení: zapojení do stejnosměrného proudu a elektrolýza
OLOVĚNÝ AKUMULÁTOR
- napětí: 2 V
- v autě jich je 6 vedle sebe (celkem tedy 12 V)
- mřížkové desky (odddělené separátorem) v pastě PbSO4 a H2SO4
- nabíjení elektrolýzou:
- katoda (-): PbII + 2 e- → Pb0
- anoda (+): PbII - 2 e- → PbIV (na PbO2)
- vybíjení jako galvanický článek:
- anoda (-): Pb0 - 2 e- → PbII
- katoda (+): PbIV + 2 e- → PbII
- prohodily se názvy elektrod, ale náboje zůstaly na stejných místech
- souhrnně: 2 PbSO4 + 2 H2O ⇄ Pb + PbO2 + 2 H2SO4
(doprava nabíjení, doleva vybíjení)
NIKL-KADMIOVÝ AKUMULÁTOR
- nosičem je mikroporézní nikl nebo nerezová ocel
- póly: Cd(OH)2 a Ni(OH)2
- elektrolyt: KOH
- separátor také napuštěn elektrolytem KOH
- napětí: 1,4 V
- souhrnně: Cd(OH)2 + 2 Ni(OH)2 ⇄ 2 NiO(OH) + Cd + 2 H2O (doprava nabíjení, doleva vybíjení)
Jirka
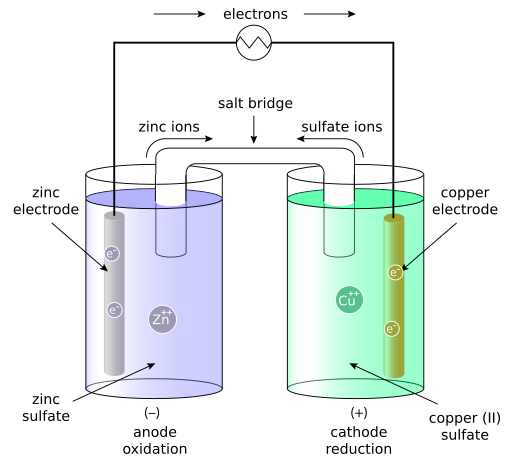
Danielův článek (šedě zinková anoda v modrém roztoku, zlatě měděná katoda v zeleném roztoku, mezi nimi bíle vodíkový můstek;
větší obrázek se po kliknutí otevře v novém okně)
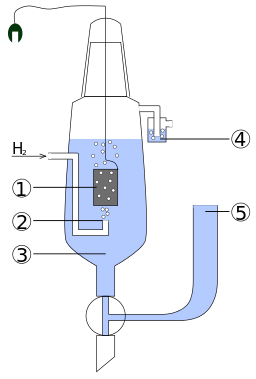
vodíková elektroda (modře roztok HCl, šedivě platinová čerň sycená plynným vodíkem)

suchý článek (šedá tyč uvnitř je kladně nabitá uhlíková katoda, okolo šedě pasta z MnO2, bíle pasta z NH4Cl,
po okrajích záporně nabitá zinková anoda; větší obrázek se po kliknutí otevře v novém okně)

automobilový olověný akumulátor
